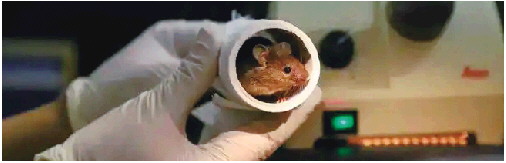
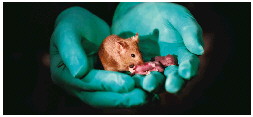
靠“爹”也能生娃?
我国科学家培育的“双父小鼠”成年了
齐鲁晚报 2025年03月08日
主笔:于梅君
不靠鼠妈也能生崽?我国科学家让看似不可能的事变成了现实:利用胚胎干细胞工程技术,成功让两个鼠爸“生”下的鼠宝宝,创纪录地活到成年,克服了哺乳动物单性生殖中前所未有的挑战。
天生就没妈 “双父小鼠”奇迹长大
自然界中,哺乳动物的繁殖通常需要精子和卵子结合,但我国科学家却打破这一传统认知,通过技术手段,成功培育出“双父”小鼠,而且这个天生没妈的小鼠,顽强活到了成年。这一突破性成果,近日在《细胞·干细胞》杂志上发表,被评价为“克服了哺乳动物单性生殖中前所未有的挑战”。
其实,同性生殖在动物中并不罕见,蜥蜴、蛙以及多种鱼类,都有“孤雌生殖”现象:即雌性不与雄性交配,即可生下后代。但“孤雄生殖”极其罕见,以前只在一种斑马鱼中发现。
“双父小鼠”的诞生,标志着科学家在实验室中成功实现了雄性细胞向卵细胞的转化,并将其用于生殖过程。这是怎么做到的?
中国科学院动物研究所研究团队利用胚胎干细胞工程技术,通过精准修改关键“印记基因”,克服了哺乳动物单性生殖的长期障碍。其实验过程,可大体归为以下几步:
1、基因编辑:研究人员利用CRISPR-Cas9基因编辑技术,删除了雄性小鼠胚胎干细胞中的特定基因(如Sry基因),使其能够发育成卵细胞。
这一过程,涉及删除或修改与性别决定相关的基因,从而使雄性细胞具备转化为卵细胞的潜力。
2、细胞转化:干细胞具有分化为多种细胞类型的能力。在“双父小鼠”的实验中,科学家将雄性小鼠的皮肤细胞,转化为诱导多能干细胞(iPS细胞),再通过基因编辑将其转化为卵细胞,并在实验室中培养成熟。
3、体外受精:将转化后的卵细胞与另一只雄性小鼠的精子结合,形成受精卵。
4.胚胎移植:将受精卵植入雌性小鼠的子宫中,最终成功诞生了双父小鼠。
这一实验,证明了雄性细胞也可以转化为卵细胞,打破了传统生殖生物学中的性别限制,推动了基因编辑技术的发展。
神秘的“印记基因”: 是它关上单性繁殖大门
按照正常理解,我们每一个人,都是从受精卵发育而来,而受精卵又是从拥有23条染色体的精子和拥有23条染色体的卵子结合形成的。在这个过程中,既少不了爸爸,也少不了妈妈。
但科学家想探究的问题是,为什么两个精子或两个卵子,就不能结合成一个拥有完整染色体的细胞,并发育成完整个体呢?
从20世纪80年代起,科学家就踏上了哺乳动物单性生殖研究的征途。但最初的尝试令人沮丧,尽管他们能够培育出全母源动物胚胎,但一旦将其移植到母体子宫,就像被施了魔咒,无一例外地停止发育,最终胎死腹中。这到底是为什么?
20世纪90年代初,科学家在哺乳动物中,发现了一类特殊的基因——印记基因。
“普通基因可以平等地表达父母双方的遗传信息,而印记基因却很任性,只从父本或母本一方表达,另一方则默默‘隐身’。”中国科学院动物研究所研究员李伟介绍,印记基因就像盖章认证一样,标明它们是来自父亲还是来自母亲。
在哺乳动物中,印记基因是一类特殊基因,它们在精子和卵子中,以不同方式表达,使得后代需要同时从父母双方获得基因才能正常发育。如果后代缺少父方或母方的印记基因,就会出现严重的健康问题,甚至无法正常发育。
也就是说,“印记基因”凭借独特的表达方式,关上了单性繁殖的大门。
为进一步揭开单性繁殖的神秘面纱,科研人员成功构建了携带20个印记区段基因编辑的孤雄(没有妈妈遗传信息)单倍体胚胎干细胞,并将其与精子共同注入去核的动物卵细胞,成功转化为可存活的动物胎儿和功能完整的胎盘。研究人员认为,新研究再次有力表明,“印记基因”是阻碍哺乳动物单性繁殖的主要障碍。
“双父小鼠”面临的挑战:不育且寿命短
“通过技术手段诞生的孤雄小鼠,相比普通小鼠有显著不同。它们体重增长迅速,当普通小鼠长到20克时,孤雄小鼠的体重已达到30克。孤雄小鼠还表现出更强的探索欲,在旷场实验中频繁进入中心区域,这与啮齿类动物习惯沿边缘活动的习性大相径庭。”研究者介绍。
不过,人工培育出的“双父”小鼠,还无法达到普通小鼠的发育水平。仅有11.8%的“双父”小鼠胚胎能发育到出生,而存活到成年的小鼠全部不育,并且寿命仅为普通小鼠的约60%。这说明,尽管技术已经取得一定进展,但要达到理想的繁殖效果,还需要进一步研究和优化。
根据国际伦理规范,这类单性生育技术不允许用于人类繁殖领域,仅限于基础研究应用。
我国科研团队表示,将继续探索如何通过“印记基因”修饰,提高胚胎发育潜能,并计划将这类技术应用于猴子等更大型哺乳动物的单性繁殖,相关技术未来有望用于再生医学领域。
“双母”小鼠长大后,又生下自己的宝宝
其实,除了“双父”小鼠,科学家也已培育出“双母”小鼠。
2004年,日本研究人员首次通过扭转印记信号的方法,培育出了拥有两位母亲的小鼠,不过他们的成功率并不高:400多个胚胎只诞生了10只小鼠幼崽,最终只有一只发育为成年鼠。
2018年,中国科学院动物研究所的李伟团队创造了“进阶版”的“双母小鼠”,他们使用CRISPR基因编辑技术,精准地调控了3个印记基因位点,然后将经过改造的细胞,注射到另一只雌性小鼠的卵细胞中,模拟受精过程。
以这种方式创造的210个胚胎中,29只小鼠顺利出生——占比14%。双母小鼠的存活率升高了,器官发育和代谢水平也与普通小鼠相当。这些幼崽能够发育成熟并拥有自己的后代,这一成就,超过了之前日本学者创造出的双母小鼠。
研究单性繁殖,更多是应用在医学领域
对“双母”或“双父”小鼠,可能有人觉得,这要么是科学家的猎奇实验,要么只是为了让同性伴侣能够拥有携带自己遗传基因的孩子。
但科学研究的意义不止于此,它们看似颠覆了自然法则,其实揭露了生命更深层的秘密:进化给哺乳动物套上的“生殖枷锁”,原来是一串可以破解的密码。当科学家拿着基因剪刀解谜时,其实也是在为疾病和生殖,寻找更多的可能性。
科学界认为,印记基因可能是哺乳动物进化出的一种保险机制,强制要求父母双方的基因参与。父源基因普遍促进营养摄取,而母源基因则限制资源消耗,只有两者平衡,胚胎才能在母体中正常发育,既能获取足够的营养,又不会因此榨干母亲的身体。
但是,这种机制并不是只有好处,一旦“印记基因”发生突变,就有可能引起发育疾病和癌症。比如,贝—维综合征,就是因为父源基因IGF2过度表达,导致器官过度生长,患者出现巨舌、内脏肥大等问题;天使综合征则是因为母源基因UBE3A缺失,导致患者出现严重的智力障碍、共济失调,还会莫名其妙发笑。
不少癌症也与印记基因的异常密切相关,如结直肠癌患者中,30%有IGF2基因印记缺失,但这一比例在健康人群中只有10%。
现在,科学家通过调控印记基因,创造出双母/双父小鼠,就意味着他们可以直接观察父源或母源基因缺失或表达过多的后果,从而探索新的基因治疗方法。
不孕不育患者,也有可能通过细胞重编程和基因编辑,用体细胞来创造出功能性生殖细胞。
濒危动物也能受益,有了双母/双父生子的技术,就有可能通过单一性别进行繁育,对于只剩下两个雌性个体的北白犀等物种来说,这可能是将它们从灭绝边缘拯救回来的希望。
不靠鼠妈也能生崽?我国科学家让看似不可能的事变成了现实:利用胚胎干细胞工程技术,成功让两个鼠爸“生”下的鼠宝宝,创纪录地活到成年,克服了哺乳动物单性生殖中前所未有的挑战。
天生就没妈 “双父小鼠”奇迹长大
自然界中,哺乳动物的繁殖通常需要精子和卵子结合,但我国科学家却打破这一传统认知,通过技术手段,成功培育出“双父”小鼠,而且这个天生没妈的小鼠,顽强活到了成年。这一突破性成果,近日在《细胞·干细胞》杂志上发表,被评价为“克服了哺乳动物单性生殖中前所未有的挑战”。
其实,同性生殖在动物中并不罕见,蜥蜴、蛙以及多种鱼类,都有“孤雌生殖”现象:即雌性不与雄性交配,即可生下后代。但“孤雄生殖”极其罕见,以前只在一种斑马鱼中发现。
“双父小鼠”的诞生,标志着科学家在实验室中成功实现了雄性细胞向卵细胞的转化,并将其用于生殖过程。这是怎么做到的?
中国科学院动物研究所研究团队利用胚胎干细胞工程技术,通过精准修改关键“印记基因”,克服了哺乳动物单性生殖的长期障碍。其实验过程,可大体归为以下几步:
1、基因编辑:研究人员利用CRISPR-Cas9基因编辑技术,删除了雄性小鼠胚胎干细胞中的特定基因(如Sry基因),使其能够发育成卵细胞。
这一过程,涉及删除或修改与性别决定相关的基因,从而使雄性细胞具备转化为卵细胞的潜力。
2、细胞转化:干细胞具有分化为多种细胞类型的能力。在“双父小鼠”的实验中,科学家将雄性小鼠的皮肤细胞,转化为诱导多能干细胞(iPS细胞),再通过基因编辑将其转化为卵细胞,并在实验室中培养成熟。
3、体外受精:将转化后的卵细胞与另一只雄性小鼠的精子结合,形成受精卵。
4.胚胎移植:将受精卵植入雌性小鼠的子宫中,最终成功诞生了双父小鼠。
这一实验,证明了雄性细胞也可以转化为卵细胞,打破了传统生殖生物学中的性别限制,推动了基因编辑技术的发展。
神秘的“印记基因”: 是它关上单性繁殖大门
按照正常理解,我们每一个人,都是从受精卵发育而来,而受精卵又是从拥有23条染色体的精子和拥有23条染色体的卵子结合形成的。在这个过程中,既少不了爸爸,也少不了妈妈。
但科学家想探究的问题是,为什么两个精子或两个卵子,就不能结合成一个拥有完整染色体的细胞,并发育成完整个体呢?
从20世纪80年代起,科学家就踏上了哺乳动物单性生殖研究的征途。但最初的尝试令人沮丧,尽管他们能够培育出全母源动物胚胎,但一旦将其移植到母体子宫,就像被施了魔咒,无一例外地停止发育,最终胎死腹中。这到底是为什么?
20世纪90年代初,科学家在哺乳动物中,发现了一类特殊的基因——印记基因。
“普通基因可以平等地表达父母双方的遗传信息,而印记基因却很任性,只从父本或母本一方表达,另一方则默默‘隐身’。”中国科学院动物研究所研究员李伟介绍,印记基因就像盖章认证一样,标明它们是来自父亲还是来自母亲。
在哺乳动物中,印记基因是一类特殊基因,它们在精子和卵子中,以不同方式表达,使得后代需要同时从父母双方获得基因才能正常发育。如果后代缺少父方或母方的印记基因,就会出现严重的健康问题,甚至无法正常发育。
也就是说,“印记基因”凭借独特的表达方式,关上了单性繁殖的大门。
为进一步揭开单性繁殖的神秘面纱,科研人员成功构建了携带20个印记区段基因编辑的孤雄(没有妈妈遗传信息)单倍体胚胎干细胞,并将其与精子共同注入去核的动物卵细胞,成功转化为可存活的动物胎儿和功能完整的胎盘。研究人员认为,新研究再次有力表明,“印记基因”是阻碍哺乳动物单性繁殖的主要障碍。
“双父小鼠”面临的挑战:不育且寿命短
“通过技术手段诞生的孤雄小鼠,相比普通小鼠有显著不同。它们体重增长迅速,当普通小鼠长到20克时,孤雄小鼠的体重已达到30克。孤雄小鼠还表现出更强的探索欲,在旷场实验中频繁进入中心区域,这与啮齿类动物习惯沿边缘活动的习性大相径庭。”研究者介绍。
不过,人工培育出的“双父”小鼠,还无法达到普通小鼠的发育水平。仅有11.8%的“双父”小鼠胚胎能发育到出生,而存活到成年的小鼠全部不育,并且寿命仅为普通小鼠的约60%。这说明,尽管技术已经取得一定进展,但要达到理想的繁殖效果,还需要进一步研究和优化。
根据国际伦理规范,这类单性生育技术不允许用于人类繁殖领域,仅限于基础研究应用。
我国科研团队表示,将继续探索如何通过“印记基因”修饰,提高胚胎发育潜能,并计划将这类技术应用于猴子等更大型哺乳动物的单性繁殖,相关技术未来有望用于再生医学领域。
“双母”小鼠长大后,又生下自己的宝宝
其实,除了“双父”小鼠,科学家也已培育出“双母”小鼠。
2004年,日本研究人员首次通过扭转印记信号的方法,培育出了拥有两位母亲的小鼠,不过他们的成功率并不高:400多个胚胎只诞生了10只小鼠幼崽,最终只有一只发育为成年鼠。
2018年,中国科学院动物研究所的李伟团队创造了“进阶版”的“双母小鼠”,他们使用CRISPR基因编辑技术,精准地调控了3个印记基因位点,然后将经过改造的细胞,注射到另一只雌性小鼠的卵细胞中,模拟受精过程。
以这种方式创造的210个胚胎中,29只小鼠顺利出生——占比14%。双母小鼠的存活率升高了,器官发育和代谢水平也与普通小鼠相当。这些幼崽能够发育成熟并拥有自己的后代,这一成就,超过了之前日本学者创造出的双母小鼠。
研究单性繁殖,更多是应用在医学领域
对“双母”或“双父”小鼠,可能有人觉得,这要么是科学家的猎奇实验,要么只是为了让同性伴侣能够拥有携带自己遗传基因的孩子。
但科学研究的意义不止于此,它们看似颠覆了自然法则,其实揭露了生命更深层的秘密:进化给哺乳动物套上的“生殖枷锁”,原来是一串可以破解的密码。当科学家拿着基因剪刀解谜时,其实也是在为疾病和生殖,寻找更多的可能性。
科学界认为,印记基因可能是哺乳动物进化出的一种保险机制,强制要求父母双方的基因参与。父源基因普遍促进营养摄取,而母源基因则限制资源消耗,只有两者平衡,胚胎才能在母体中正常发育,既能获取足够的营养,又不会因此榨干母亲的身体。
但是,这种机制并不是只有好处,一旦“印记基因”发生突变,就有可能引起发育疾病和癌症。比如,贝—维综合征,就是因为父源基因IGF2过度表达,导致器官过度生长,患者出现巨舌、内脏肥大等问题;天使综合征则是因为母源基因UBE3A缺失,导致患者出现严重的智力障碍、共济失调,还会莫名其妙发笑。
不少癌症也与印记基因的异常密切相关,如结直肠癌患者中,30%有IGF2基因印记缺失,但这一比例在健康人群中只有10%。
现在,科学家通过调控印记基因,创造出双母/双父小鼠,就意味着他们可以直接观察父源或母源基因缺失或表达过多的后果,从而探索新的基因治疗方法。
不孕不育患者,也有可能通过细胞重编程和基因编辑,用体细胞来创造出功能性生殖细胞。
濒危动物也能受益,有了双母/双父生子的技术,就有可能通过单一性别进行繁育,对于只剩下两个雌性个体的北白犀等物种来说,这可能是将它们从灭绝边缘拯救回来的希望。